前回の記事ではイオン化傾向の中でも
水との反応で覚えるべきポイントにしぼって解説しました。
今回の記事ではイオン化傾向の中でも酸との反応について
解説したいと思います。
酸との反応はどうなる?イオン化傾向のポイント
K>Ca>Na>Mg>Al>Zn(亜鉛)>Fe(鉄)>Ni>Sn(スズ)>Pb(鉛)>(H2)>Cu>Hg>Ag>Pt>Au
貸そうかなまああてにすんなひどすぎる借金
K(貸そう)>Ca(か)>Na(な)
>Mg(ま>Al(あ)>Zn(あ)>Fe(鉄)>Ni(に)>Sn(すん)>Pb(な)
>(H2)(ひ)>Cu(ど)>Hg(す)>Ag(ぎる)>Pt(借))>Au(金)
です。
ジャニーズとか下ネタでイオン化傾向を覚えたい方はこちらをご覧ください。
⇒イオン化傾向の覚え方(ジャニーズや下ネタを活用)
まず大前提として
イオン化傾向が強い=還元剤として強いです。

イオン化傾向がK(カリウム)から$H_2 $(水素)のところまでというのは
還元剤として強いので酸との反応性は強いです。
なので希硫酸、希塩酸や濃塩酸と反応します。
結果、$H_2 $(水素ガス)が発生します。
・酸とは水素イオン($H^{+} $)を出す物質のこと
・還元剤は電子($e^{ー} $)を放出する物質のこと
です。
ちなみに鉛(Pb)は希硫酸、希塩酸や濃塩酸と一瞬しか反応しません。
Pbの周りに$PbCl_2 $とか$PbSO_4 $などの
衣(ころも)がくっつく感じになります。
表面が薄い皮($PbCl_2 $とか$PbSO_4 $など)を
被ったような状態になります。
中まで反応が進行しにくいってことです。
「亜硫酸、亜硝酸」
これらは、硫酸や硝酸に似ていて劣っているという意味です。
『鉛:ずっしりと重くて酸とも反応しにくい
亜鉛:軽くて酸と反応しやすい
野外放置で
鉛:表面に薄く皮を被ったような状態になる。少し削れば金属光沢が出る。
亜鉛:ボロボロになる。』— 腸へい🗣 DIY腸管免疫(2万) (@Immune_Power) August 28, 2021
コロッケを油の中に入れたら・・・
コロッケの表面が反応して焦げるじゃないですか。

これと同じで鉛を希硫酸、希塩酸や濃塩酸の中に入れると
一瞬反応して表面に衣ができたような状態になるのです。
こんな感じで衣がついてしまいます。
しかもこの衣のキメはすごく細かいです。

なので完全に$PbCl_2 $とか$PbSO_4 $の衣に覆われてしまって
内部まで反応しにくい状態になっています。
外だけ反応して中身が生き残った状態になります。
だからPbについては希硫酸、希塩酸や濃塩酸とは一瞬しか反応しませんが
表面だけ反応します。
ということで水素よりイオン化傾向の大きな金属は
希硫酸、希塩酸や濃塩酸と反応して水素の泡が発生します。
ただ、前回の記事で解説しましたが
水でさえ、NaとかKやCaと反応すると爆発の可能性があって危険です。
イオン化傾向の大きなNaやKやCaはあまりに危なすぎます。
だから小学校とか中学校くらいのときに
水素を発生させる実験でNa(ナトリウム)やK(カリウム)を入れさせるところはないはずです。
なぜなら爆発の危険性があるからです。
やってませんて。RT @BB45_Colorado: 小学校や中学校の理科の時間に、ナトリウムやカリウムを水に放り込む実験を見ている筈なんだけどね。
— 漆畑文哉 (@uru_) March 23, 2012
だからイオン化傾向がそんなには大きくない
Fe(鉄)とかZn(亜鉛)などを希硫酸や希塩酸と反応させて
水素の泡が出ることを確かめさせます。
たとえば鉄くぎなんかを実験では利用することが多いです。
ということで
あまりにイオン化傾向が大きいものは危険だということで
ほどほどの鉄や亜鉛などを反応させて水素を発生させることが多いです。
それからCu(銅)やAg(銀)というのは
希硫酸や希塩酸や濃塩酸とは反応しません。
たとえば希硫酸の中に10円玉を入れても反応しません。
銅はイオン化傾向が小さいので酸には溶けないのでは?という疑問は,化学を勉強した人がもつかも知れません。確かに金属銅は希硫酸などに溶けませんが,銅の酸化物や塩は酸で溶けます。10円玉を酢で磨く原理。水あかに含まれる銅というのはそういう物質だったと思われます。https://t.co/Esc4yBkKp7
— こなみひでお (@konamih) July 9, 2020
では銅や銀はどうやって反応させるのでしょう?
希硫酸や希塩酸や濃塩酸はダメだったら
何と反応させればよいのでしょう?

結論としては希硝酸(希$HNO_3 $)や濃硝酸(濃$HNO_3 $)
や加熱した濃硫酸(熱濃硫酸といいます)となら反応します。
ということで10円玉(銅)や銀を溶かそうと思ったら
希硝酸、濃硝酸、加熱した濃硫酸を使う必要があるということです。

ただ気をつけて欲しいことがあります。
濃硝酸と熱濃硫酸についてです。
まず語呂合わせがあるので覚えましょう。
てにある
て・・・Fe
に・・・Ni
ある・・・Al
『てにある(Fe、Ni、Alのこと)』は表面に酸化物の膜がくっついて
内部まで反応が進行しにくいです。
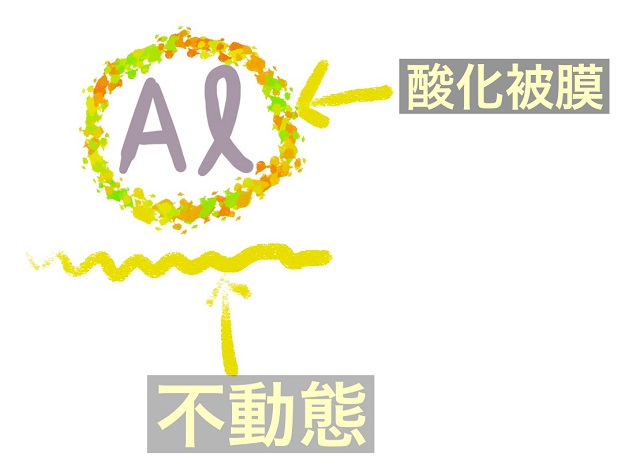
たとえばAl(アルミニウム)の表面に酸化物の膜がくっつきます。
これを酸化被膜といいます。
さきほどのPbと同じように
衣で覆われてしまうのです。
これを不動態(ふどうたい)といいます。
不動態の態(たい)は熊(クマ)ではありませんからね。
試験で熊(クマ)を書いたらバツになりますからご注意ください。
【アルミニウム】
アルミ箔や1円玉、ボーキサイトで有名! 酸や塩基と両方と反応し、このような元素を両性元素と言います
濃硝酸では表面に酸化物の皮膜が生じ反応がそれ以上進みません(不動態)
写真は液体アルミニウム(融点660℃) pic.twitter.com/mM7vpnhB0C— 実験たん (@Experiment_tan) January 22, 2023
表面にキメの細かい酸化物の膜である酸化被膜がくっついて
内部まで反応が進みません。
この全体が不動態です。
ただ衣の種類がPbの場合とは違います。

Pbの方は沈殿という衣がくっつきます。

でも、Alの方は酸化物という衣がくっつきます。
・鉛(Pb)の衣は沈殿物($PbCl_2 $とか$PbSO_4 $)
・アルミニウム(Al)の衣は酸化物($Al_2O_3 $)
ということです。
具体的にAlの衣である酸化物は『$Al_2O_3 $』です。
ということで
熱濃硫酸や濃硝酸だとFe(鉄)、Ni(ニッケル)、
Al(アルミニウム)は不動態を作るのでほとんど反応しません。
あと、王様の水というのがあります。
これを王水といいます。

王水は白金や金ですら溶かしてしまいます。
王水は濃塩酸と濃硝酸を混ぜ合わせたものです。
昔、金や白金を取られそうになったので
王様の水(王水)に溶かして溶液にして隠していて逃げ切ったという話があります。
逃げ切った後、復活させたということです。
酸との反応はどうなる?イオン化傾向のポイントまとめ
結局金属というのはいろいろありますが
何かしらの酸と反応するということです。
王水も濃硝酸や濃塩酸が入ってますから酸ですからね。
今回の記事は以上となります。















