今回の記事ではボイルの法則についてわかりやすく解説します。
Contents
ボイルの法則とは?を理解する大前提
ボイルの法則について理解する大前提として気体の知識が必須になります。
そこで先に気体全般について解説しますね。
ボイルの法則を理解する大前提|気体の学習で登場する4つの変数とは?
気体の学習では4つの変数が登場します。
(1)圧力(P)
(2)体積(V)
(3)物質量(n)
(4)絶対温度(T)
です。
圧力Pは英語でpressureなので、頭文字をとってPと書くことが多いです。
圧力の単位はatm(アトム)、これは気圧という意味です。
他にも単位としてPa(パスカル)、mmHg(ミリメートル水銀)で表されます。
次に体積VはvolumeのVです。
単位として使うのはL(リットル)と$m^{3} $(立法メートル)です。
物質量はnで単位はmol(モル)です。
・モル(物質量)とは?わかりやすく解説
・モル濃度の簡単な求め方についてわかりやすく解説
・1モルから得られる3つの情報とは?わかりやすく解説
・3つのモル公式の覚え方をわかりやすく解説
・モル濃度とは?わかりやすく解説
そして絶対温度T、temperatureのTです。
単位はK(ケルビン)です。
℃+273=絶対温度になります。
以上4つの変数が気体では登場します。
ボイルの法則を理解する大前提|圧力Pとは?
圧力というのは容器の中に気体分子を封入します。
気体分子が容器の壁面にバンバンぶつかるわけですね。

容器の中に入っている気体分子は常に動き回っているため
容器の壁にバンバンぶつかります。
気体ですからね。固体とは違います。
容器の壁にぶつかると、力が発生します。
気体分子が容器にぶつかって生じる力を圧力といいます。

あなたが壁に思いっきりぶつかったとしましょう。
薄い壁だったら割れるかもしれませんよね。
厚い壁だと割れないかもしれませんが、壁が揺れたりすると思います。
それはあなたがぶつかったことで生じた圧力の影響です。
そう考えると理解しやすいと思います。
ボイルの法則を理解する大前提|体積V
ここで質問です。
容器の体積が大きい場合と小さい場合で
気体分子が衝突しやすいのはどっちでしょう?
衝突しやすいのは容器が小さい場合です。
容器が小さい方が壁面に衝突する可能性が高くなるのは当然ですよね。
人間で例えたら、狭い部屋に3人人がいる場合と、
めちゃくちゃ広いデパート内に3人いる場合だったら
人が壁にぶつかる確率は狭い部屋に3人いる場合の方が高くなりますよね。
これと同じことです。
こんな感じで気体が入っている容器の体積も
気体の勉強をする上で、すごく重要になってきます。
ボイルの法則を理解する大前提|物質量n
物質量は分子の数のことです。
分子の数が多ければ多いほど、ぶつかりあう分子の数も増えてきます。
なので当然、圧力Pも大きくなるのは想像に難くありません。

これも人間で例えましょうか。
満員電車と、ガラガラの電車だったら、
満員電車の方が人同士ぶつかる確率が上がるでしょうし
壁にぶつかる確率も上がるでしょう。
こんな感じで物質量も気体の勉強をする上で大事なファクターになってきます。
ボイルの法則を理解する大前提|絶対温度T
温度によって何が変わるでしょう?
温度が高くなると分子が持つ運動エネルギーが大きくなります。
分子がより激しく動くようになります。
すると分子がぶつかった時の壁面に衝突した時の衝撃も大きくなるわけです。
と考えると、温度が高くなると圧力にも影響が出てきそうですね。
ボイルの法則を理解する大前提|まとめ
・圧力P
・体積V
・物質量n
・絶対温度T
を1つの式に集約することができます。
ただ1つの式に集約するのに150年かかったそうですよ。
150年かけて、上記4つの変数が1つの式に集約されました。
もしかしたらあなたは
PV=nRT
という理想気体の状態方程式を知っているかもしれません。
でも、理想気体の状態方程式がどういったプロセスで導かれたか?
は考えたことがないかもしれませんね。
今回の記事では理想気体の状態方程式が導かれる前段階であるボイルの法則について
解説していきますね。
理想気体の状態方程式はこちらで解説しています。
・理想気体と実在気体の違いと近づける方法についてわかりやすく解説
ボイルの法則についてわかりやすく説明
ボイルの法則は1662年、ボイルさんが導いた法則です。
どういうものでしょう?
温度Tと物質量nを一定にした時、
圧力Pと体積Vは反比例の関係にある
というものです。
図で説明してみますね。
今、ピストンがついたピストン型容器があるとしましょう。
注射器みたいなものを想像してください。
自由に押して圧縮させたり、引いて膨張させたりできるようなものがピストン型容器です。
ピストン型容器の中に気体分子を封入します。
温度はT(ケルビン、K)としましょう。

上からPという圧力を加えます。
このとき容器の体積がV(L)だったとします。
温度と中に入っている気体分子の数は変えずに
そのまま、上からかけている圧力Pを2倍に強めましょう。
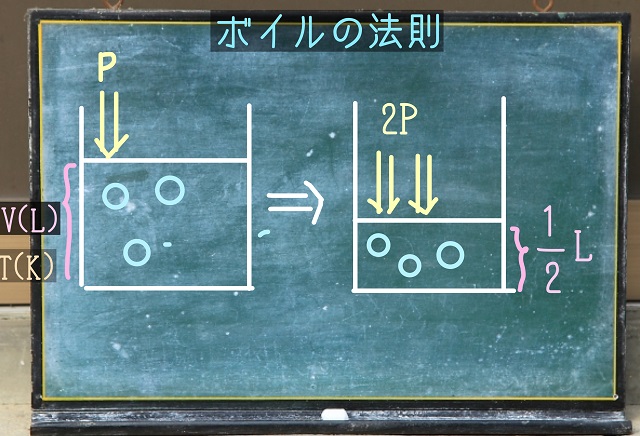
すると中の体積が2分の1V(L)になるということを
ボイルさんは発見しました。
圧力Pが2倍になると体積は、2分の1倍になる、
これをボイルの法則といいます。
圧力Pと体積Vは反比例するという法則のこと
です。
ボイルの法則を式で書くと
P=$\frac{定数}{V} $
変形すると
PV=一定
となります。
これが1662年に発表されたボイルの法則です。
そしてボイルの法則から125年後、2つ目の気体の法則(シャルルの法則)が発表されました。
次の記事ではシャルルの法則について解説します。
⇒シャルルの法則が当てはまる身近な例とは?