今回の記事では塩化ナトリウムからの挑戦状!
電気分解で水酸化ナトリウムを作り出す隔膜法の謎に迫るってテーマで
解説します。
塩化ナトリウムの電気分解:隔膜法
前回解説した接触法は何を作ったか?
硫酸を作るのでした。
⇒接触法の反応式についてわかりやすく解説
では今回解説する隔膜法は何を作るのでしょう?
隔膜法は水酸化ナトリウムを作る方法です。
単に食塩水を電気分解しても仕方がありませんからね。
最近は陽イオン交換膜という高級なものを使うことが多いです。
でも素焼き板でもできます。
以前、ダニエル電池の解説で素焼き板について解説していますが
これで十分できます。
⇒ダニエル電池の半反応式と起電力を高くする方法について解説
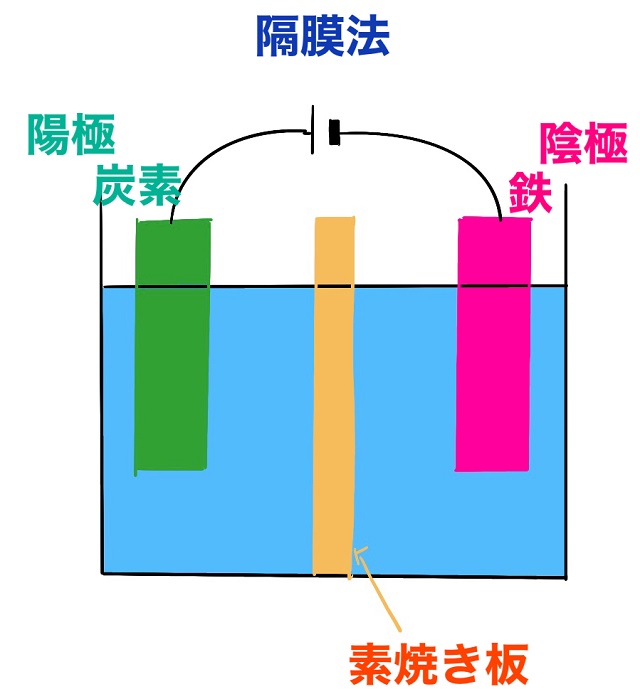
話を元に戻します。
陽極は炭素棒で電池をはさみ、陰極は鉄です。
上記の図の状態ですが、
電気分解の知識は必須なので、よくわからない方は
こちらの記事を参考にしてくださいね。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
⇒電気分解陰極の特徴・考え方についてわかりやすく解説
隔膜法:陽極の反応

電気分解の知識、覚えていますか?
まず陽極で知っておかないといけない前提知識は?
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
陽極はまず極板をみるんでしたね。
極板は炭素Cですね。
で、炭素Cだからダメですね。
仕方がないから陰イオンをみます。
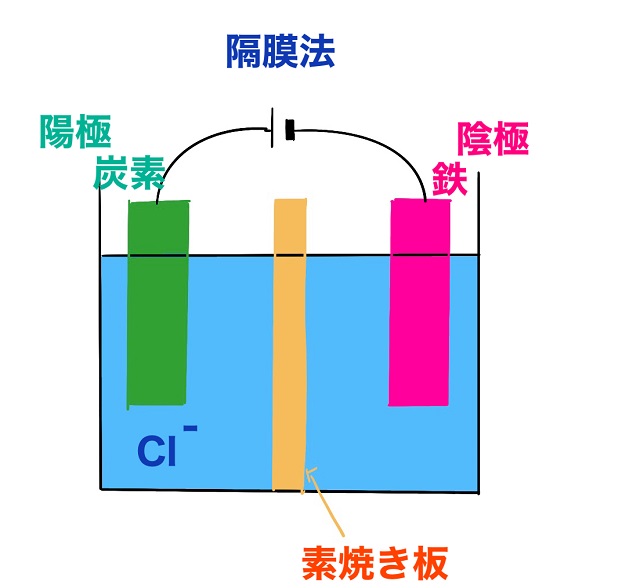
今回は塩化ナトリウム(食塩水)の電気分解です。
陰イオンは$Cl^{ー} $(塩化物イオン)ですね。
だから陽極では塩化物イオンに注目すればよいです。
塩化物イオンはいい人でしたね。
なのでちゃんと電子$e^{ー} $を出してくれます。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
よって、
$2Cl^{ー} $⇒$Cl_2 $+$2e^{ー} $
という反応が起こります。
結果、塩素$Cl_2 $が発生します。
隔膜法:陰極の反応
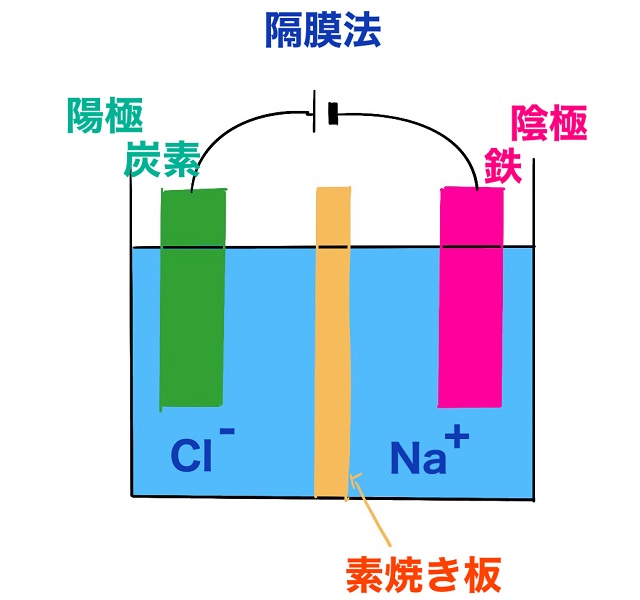
そして陰極の方は陽イオンが近づいてきます。
とにかく食塩水の電気分解なので$Na^{+} $(ナトリウムイオン)が陰極に近づいてくるわけです。
⇒電気分解陰極の特徴・考え方についてわかりやすく解説
ナトリウムイオンはイオン化傾向が大きかったですよね。
⇒イオン化傾向が大きいほど何がいえるか?
⇒イオン化傾向の覚え方(ジャニーズや下ネタを活用)
だからナトリウムは出てきません。
イオン化傾向が大きいということはイオンのままですからね。
塩化物イオンが塩素になるみたいな反応ができないってことです。
ではどうすればいいのでしょう?
そんな場合は代わりに水素が出るのでした。
水素はナトリウムよりイオン化傾向が小さいですからね。
⇒電気分解陰極の特徴・考え方についてわかりやすく解説
よって水素イオンが電子をもらって
$2H^{+} $+$2e^{ー} $⇒$H_2 $
という反応が起こります。
こんな感じで$H_2 $が発生します。
隔膜法:陰極の反応を修正する
ここまでは普通の電気分解の話です。
ここからさらに発展させていきます。
陰極で発生した
$2H^{+} $+$2e^{ー} $⇒$H_2 $
$H^{+} $って実態に合いますか?
$H^{+} $は酸性で、$NaCl $(塩化ナトリウム)は中性です。
合いませんね。
そこで実態に合うように
$2H^{+} $+$2e^{ー} $⇒$H_2 $
の反応を修正します。
そこで両辺に$2OH^{ー} $を加えます。
塩基性の$2OH^{ー} $を両辺に加えることで
酸性から中性に変えるわけです。
$2OH^{ー} $を$2H^{+} $に加えれば
酸性の原因になっている$2H^{+} $が消えて中性になりますよね。
$2H^{+} $+$2OH^{ー} $+$2e^{ー} $⇒$2OH^{ー} $+$H_2 $
となり、
$2H_2O $+$2e^{ー} $⇒$2OH^{ー} $+$H_2 $
となります。
ただ、左辺は$2H_2O $+$2e^{ー} $と中性になり
実態に合いました。
でも右辺は$2OH^{ー} $+$H_2 $と塩基性になってしまいました。
つまり、中性の食塩水を電気分解すると
陰極(マイナス)ではアルカリ性になってくるわけです。

ということで陰極付近では
イオン化傾向が大きいために$Na $(ナトリウム)になれずに
そのままの状態でいる$Na^{+} $(ナトリウムイオン)と
先ほどの修正によってできた$OH^{ー} $によって
$NaOH $(水酸化ナトリウム)ができます。
この水酸化ナトリウムが陰極付近でできるのが目的です。
こんな感じで食塩水を電気分解すると
陰極付近に水酸化ナトリウムができます。
これをありがたくもらおうということです。
隔膜法の意味
この記事のテーマは隔膜法です。
どうして隔膜で真ん中を仕切るのでしょう?

陽極付近では$Cl_2 $(塩素)が発生しました。
塩素は水に溶けやすいです。
こちらで解説しています。
⇒水に溶けやすい気体一覧【化学受験者必須知識】
陽極で発生した塩素は水に溶けて
塩酸と次亜塩素酸ができます。
以下のような式になります。
$Cl_2 $+$H_2O $⇔$HCl $(塩酸)+$HClO $(次亜塩素酸)
以上のように
$HCl $(塩酸)と$HClO $(次亜塩素酸)は2つとも酸なので
酸が2つ出てくるということがわかります。
ただ$HCl $(塩酸)は微量なので
全体的には弱酸性になります。
2つ酸が出るからもし陽極と陰極が混ざったら
以下のような反応が起こります。
$Cl_2 $+$2NaOH $⇒$NaCl $+$NaClO $+$H_2O $
ただ上記のような反応が起こったら大変です。
陽極では塩素が出ます。
陰極では水酸化ナトリウムが出ます。
もし陽極と陰極が混ざったら上記のような反応が起こります。
$Cl_2 $+$2NaOH $⇒$NaCl $+$NaClO $+$H_2O $
もし陽極と陰極が混ざったら
右辺を見ると$NaCl $ができてしまい、
最初の状態(食塩水)に戻ってしまいますね。
これでは意味がありません。
なのでこれが起こらないように隔膜で真ん中を仕切っているのです。
だから隔膜法といいます。
工業では実際に隔膜法を使って水酸化ナトリウムを作っています。
なので覚えておいて損はないでしょう。
以上で解説を終わります。