前回は別サイトでハーバーボッシュ法について解説しました。
⇒ハーバーボッシュ法とは?わかりやすく解説
今回の記事ではアンモニアソーダ法(別名、ソルベー法)について解説します。
高校の教科書に掲載されている工業的製法の中では一番歴史のある古いものです。

1866年にアンモニアソーダ法は発表されています。
このころの日本はギリギリ江戸時代です。
1867年に明治に変わるわけですからね。
そのときに発表されたのがアンモニアソーダ法です。
でも、令和3年現在でも使われています。すごいですね。
アンモニアソーダ法は炭酸ナトリウム($Na_2CO_3 $)の工業的製法です。
Contents
炭酸ナトリウムって何に利用されている?
アンモニアソーダ法で作られる炭酸ナトリウム($Na_2CO_3 $)って
何に使われているのでしょう?

炭酸ナトリウム($Na_2CO_3 $)はガラスを作る原料として使われています。

あと、炭酸ナトリウム($Na_2CO_3 $)は石鹸の原料にもなります。
日本国内でもガラスとか石鹸はたくさん利用されています。
ですから炭酸ナトリウム($Na_2CO_3 $)は大量に必要になります。
ここでアンモニアソーダ法の登場です。
アンモニアソーダ法(ソルベー法)により低コストで、
かつ、大量に炭酸ナトリウム($Na_2CO_3 $)を作ることができるんです。
ちなみにアンモニアソーダ法が発表された当初は時代としては産業革命時です。
産業革命というのは繊維が大量に作られた時代です。
繊維が作られるということは当然、石鹸が必要になりますね。
繊維でできたものを定期的に洗わないといけないわけですからね。

ということで時代のニーズに合って爆発的に炭酸ナトリウムが売れたのです。
今みたいにオキシクリーンがありませんしね。
そんなこともあってアンモニアソーダ法は当時、脚光を浴びた手法です。
アンモニアソーダ法(ソルベー法)の名前の由来
アンモニアソーダ法はソルベーさんによる方法です。
つまりソルベー法の名前の由来は開発した人の名前からきています。
産業革命時にアンモニアソーダ法を編み出したソルベーさんは当時、
大金持ちになったそうですよ。
特許をとって工場を作って
炭酸ナトリウムを大量生産したからです。
でも、これから解説する反応にはそんな特殊な反応はありません。
当時、最先端みたいな技術を使って考案した反応ではありません。
ソルベー法の素晴らしいところは
今まであるものをアイデア一本でうまく組み合わせて
低コストかつ大量生産を可能にしたことにあります。
ソルベーさんはアイデアマンなんですね。
アイデア1本で工場を作り、莫大な財産を築き上げた大変夢のある人がソルベーさんです。
どういう仕組みでどういう反応の順番で炭酸ナトリウムを大量生産しているのか?
解説していきますね。
アンモニアソーダ法(ソルベー法)の反応式|高校化学だと・・・
ソルベー法ですが、これってよく
$NaCl $+$H_2O $+$NH_3 $(アンモニア)+$CO_2 $⇒$NaHCO_3 $(炭酸水素ナトリウム)+$NH_4Cl $(塩化アンモニウム)
と習うはずです。
そして炭酸水素ナトリウムを焼いて炭酸ナトリウムを作ります。
反応式はこうなりますね。
$2NaHCO_3 $⇒$Na_2CO_3 $(炭酸ナトリウム)+$H_2O $+$CO_2 $
「これがアンモニアソーダ法(ソルベー法)の反応式ですよ!」
と高校化学の先生は説明したりします。
でもこんな二段階の反応でアンモニアソーダ法が構築されているなら
そんな画期的な製法だといわれません。
なぜなら、$NH_3 $(アンモニア)って当時はまだ値段が高いものでしたから。
まともに$NH_3 $(アンモニア)を利用したらコストが高くなります。
ハーバーボッシュ法ができる前の時代の話ですからね。
⇒ハーバーボッシュ法とは?わかりやすく解説
産業革命時ではアンモニアを大量生産できませんでしたから。
なのでこんな2段階の反応でアンモニアソーダ法だと説明できません。
実はアンモニアソーダ法には反応が5つあります。
5種類の反応からできているんです。
ここで記載しなかった残り3つ(5つのうちの)にいろんな工夫が含まれています。
ということでアンモニアソーダ法がどういう過程で進んでいくのか
反応の順番を示していきたいと思います。
アンモニアソーダ法(ソルベー法)反応の順番を図を使って説明
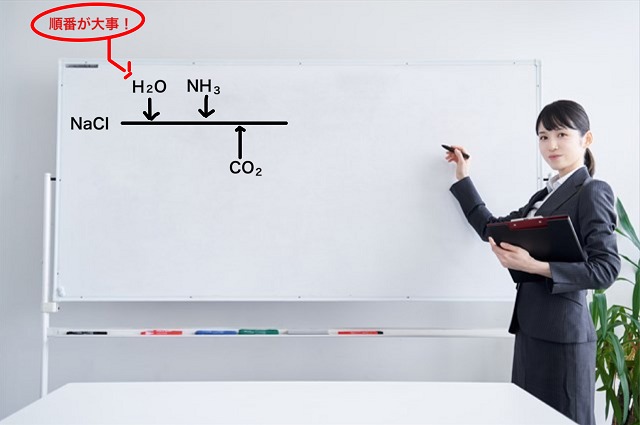
まず塩化ナトリウムを水に溶かします。
塩化ナトリウムは産業革命の時代であっても海に行ったら簡単にゲットできますね。
そして飽和水溶液の状態にします。
そこにアンモニア(気体)を吸収させます。
アンモニアは水に溶けやすい気体だからどんどん溶けていき
濃度が上がっていきます。
そして最後に二酸化炭素を吹き込みます。
ここで重要なのは順番です。
アンモニアの後に二酸化炭素を入れないと二酸化炭素の濃度を上げることはできません。
なぜか?
アンモニアは塩基性だから水溶液をアルカリ性にした後、
酸性の気体である二酸化炭素を入れると濃度が上がるのです。
ここまでの反応の順番を図で示すと以下のようになります。
このときの上記図に書いてある二酸化炭素($CO_2 $)は石灰石である炭酸カルシウム($CaCO_3 $)を
利用して作っています。
炭酸カルシウム($CaCO_3 $)を加熱すると熱分解すると
二酸化炭素($CO_2 $)という気体が発生しつつ
酸化カルシウム($CaO $)という化合物に変化します。
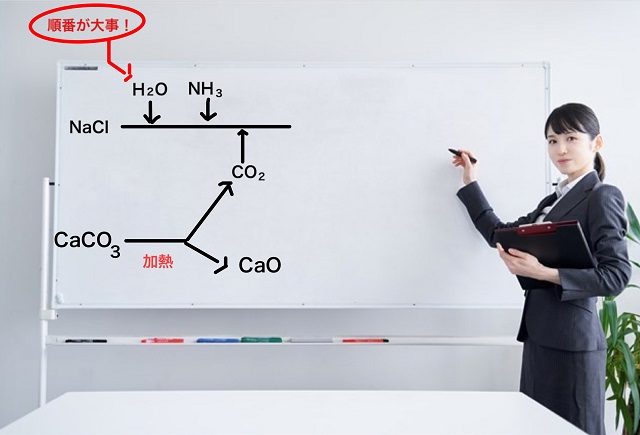
石灰石は山にあるので持ってくればOKですし、塩化ナトリウム($NaCl $)も
海水を持ってくればOKですから、どちらも低コストで手に入ります。
ところで二酸化炭素($CO_2 $)は気体です。
気体のまま貯蔵しようとすると、ものすごくかさばりますね。
無理やり狭いところに二酸化炭素($CO_2 $)を詰め込むと
中の圧力が高くなってしまい破裂してしまう。
破裂対策として頑丈な容器を作る方法もありますが、
これだと高額な費用が必要になります。
そうなったら工業的製法(安く作って高く売って儲ける)としては失格です。
だからあらかじめ炭酸カルシウム($CaCO_3 $)という固体の形で
コンパクトに貯蔵しておいて必要な分だけ熱分解で二酸化炭素($CO_2 $)という気体を作り出しています。
すごく効率がよい手法です。
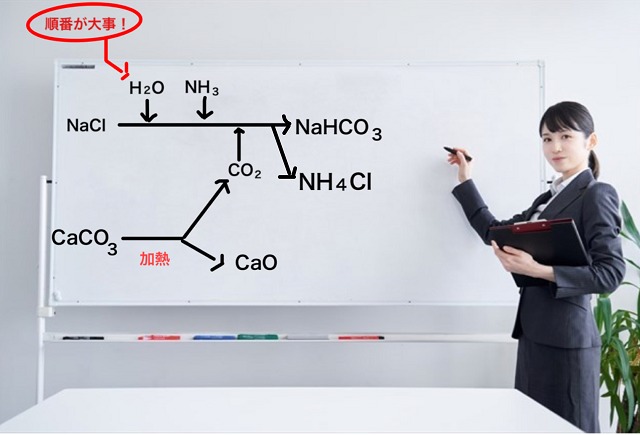
で、このときできる物質は炭酸水素ナトリウム($NaHCO_3 $)と塩化アンモニウム($NH_4Cl $)です。
炭酸水素ナトリウム($NaHCO_3 $)は別名重曹です。
重曹は洗剤としても活用されている重要な物質ですね。
⇒過炭酸ナトリウムとは重曹と何が違うの?
⇒酸素系漂白剤と重曹の違い
で、炭酸水素ナトリウム($NaHCO_3 $)を加熱すると目的物質である炭酸ナトリウム($Na_2CO_3 $)ができます。
同時に二酸化炭素($CO_2 $)という気体が発生します。
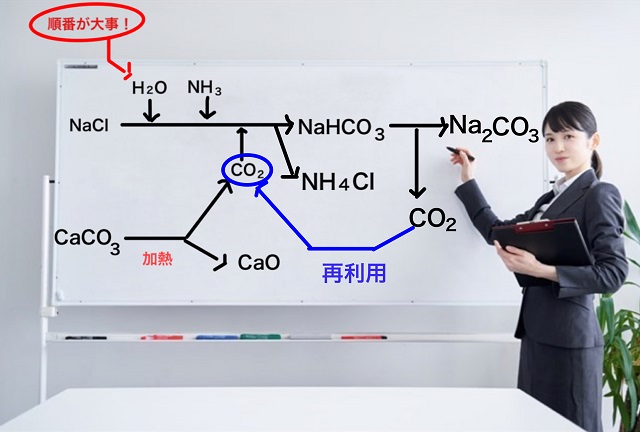
この二酸化炭素($CO_2 $)をそのまま大気中に放出するのはもったいないですし
今の地球環境でいうと温室効果ガスの排出につながってしまいます。
でも、もとの反応でもう一度使えばよいわけです。
再利用ってやつです。
つまり、できた二酸化炭素($CO_2 $)は再利用されます。
これが低コスト化につながります。
石灰岩の消費を減らす方向に向かいますからね。
さらに再利用は続きます。
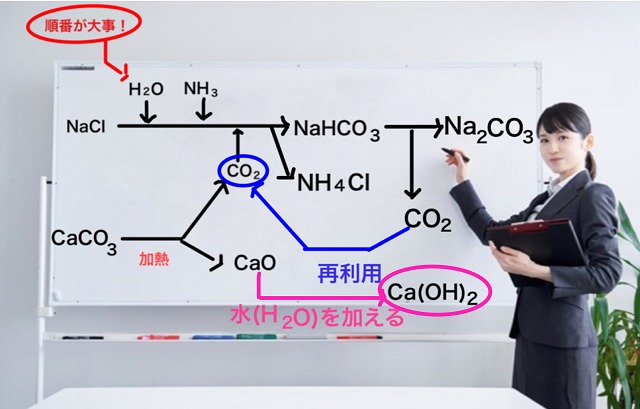
酸化カルシウム($CaO $)に水($H_2O $)を加えると水酸化カルシウム($Ca(OH_2) $)ができます。
酸化の頭に水を足すと水酸化なので覚えやすいですね。
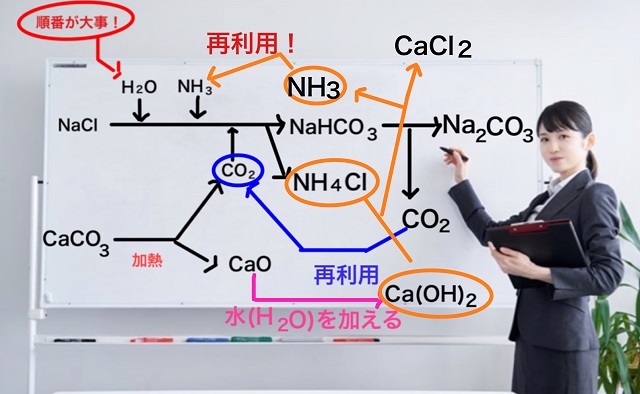
さらに水酸化カルシウム($Ca(OH_2) $)と塩化アンモニウム($NH_4Cl $)が反応すると、
塩化カルシウム($CaCl_2 $)という化合物ができると同時にアンモニア($NH_3 $)という気体がでてきます。
このアンモニアは再利用可能ですね。
産業革命時に高額だったアンモニアは再利用ができることになりますね。
しかもアンモニアの再利用率は100%です。
最初に使った分が全部返ってくるという計算になります。
ということは最初にアンモニアを供給しておけば半永久的にずっと
アンモニアを追加供給せずに工場は稼働することになります。
もちろん、そんな理想的な稼働は難しいですが、
でも追加で供給しないといけない量は相当に減らすことができます。
アンモニアという一番値段の高い原料を100%再利用することができます。

最初に入れたアンモニアの窒素なったあと、Nは塩化アンモニウム($NH_4Cl $)の窒素Nになります。
次に塩化アンモニウム($NH_4Cl $)の窒素Nになったあと、アンモニア($NH_3 $)の窒素Nになるわけです。
こんな風に窒素Nを追跡してみるとよくわかりますね。
原料の再利用を徹底的にすることで
低コスト、大量生産を可能にしています。
これはアンモニアソーダ法のメリットといえますね。
特殊な反応は1つもありません。
非常にシンプルな反応ばかりです。
でもそれを安い原料で実現しているところにアンモニアソーダ法のすごさがあるわけです。
アンモニアソーダ法の反応順序は以下のようになります。
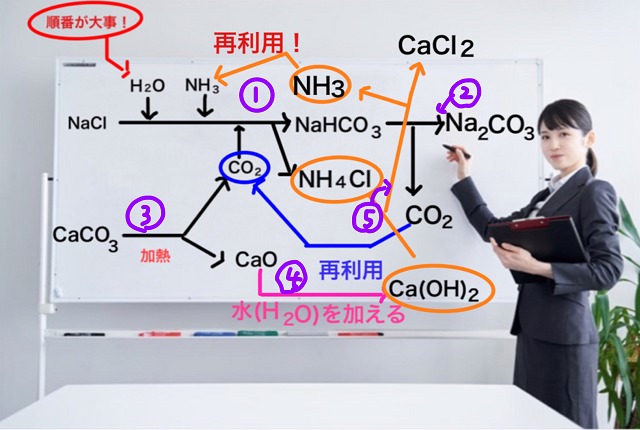
1から5まで、全部で5つの反応(順番)から構成されています。
なので、化学反応式は5種類あるということになります。
以上で解説を終わります。