今回の記事では物質量(モル)とは何か?
わかりやすく解説していきたいと思います。
物質量(モル)とは?
まず物質量の単位はモル(mol)です。
なので、モルとは?と聞かれたら、「物質量の単位のことですよ」と答えます。
で、物質量というのはモル数といったりますが、
いったい何を表現したものなのでしょう?
物質量について理解するために
まずは粒子について知っておきましょう。
原子とか分子とかイオンなどを全部ひっくるめたもののこと
です。
で、物質量とは『粒子の数を表したもの』です。
『数』というところが重要です。
大丈夫ですか?
物質量(モル数)というのは原子とか分子とかイオンの数を表現したものです。
前回の記事では質量を表現したもので、
相対質量について解説しました。
⇒相対質量とは?わかりやすく解説
質量も膨大な量ありましたが、
数も膨大な数があります。
原子の数とか分子の数とか、イオンの数とか
小さい粒子なわけですから、数も膨大にあるわけです。
これを具体的に何個と数字で書いていくと大変ですし面倒です。
「もう少し見やすい数字を作ろう!」ということで
新たに作られた化学量が『物質量』ということになります。
よく例えとして12個の集団を1ダースと呼ぶことがあります。
モルも同じです。
ある一定の数の集団のことを1モルという風に表現します。
そんな風に12個で1ダース、~個で1モルという風に覚えた方もいるでしょう。
ただ、単純に12個で1ダースではなくて、
こういった数字が出てくるプロセスまで理解しておいた方が
今後の化学の学習に繋がっていくと思いますし、
オキシクリーンなどの洗剤の仲間を化学的に理解するときに役立つと思います。
ということでモルとはいったい何なのか?ということを解説します。
モルとはいったい何なのか?わかりやすく解説
まず、量りに原子を乗せていてきます。
この原子ですが、質量数が12の炭素原子(${}^{ 12 } C $)としましょう。
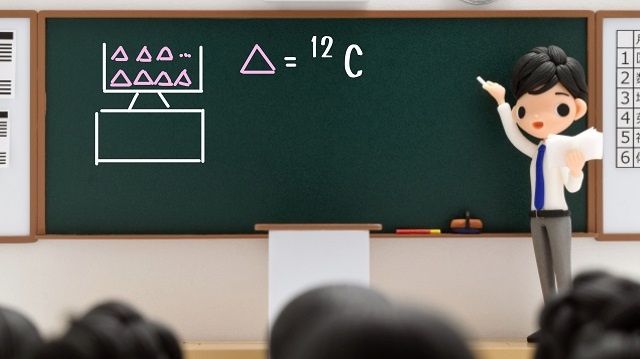
上記図のように質量数12の炭素原子を量りにのせていくわけですが、
量りの目盛りが12グラムという目盛りになるまで乗せていきます。
質量数が12の炭素原子は相対質量も12ですが。
⇒相対質量とは?わかりやすく解説
これを12g(グラム)という質量になるまで量りにのせていきます。
で、12グラムになったときに量りの上に乗っかっている炭素原子の数が
6.02×$10^{23} $個になることが知られています。
つまり、質量数12の炭素原子(相対質量の基準となる原子)が12gになるまで
量りにのせると、6.02×$10^{23} $個のせることになるわけですね。
で、6.02×$10^{23} $個のことをアボガドロ数という風に定義しました。
そしてアボガドロ数個の数の集団のことを1mol(モル)という風に定義しました。
要するに2段階に定義が入っています。
質量数が12の炭素原子を12gになるまで量りにのせたときの原子の数をアボガドロ数と定義し、
アボガドロ数個の数の集団を1molと呼ぶことにしましょうとなったわけです。

なので、単純に12個で1ダースというのとちょっと意味合いが違いますね。
なぜなら、molというものを出すときには
最初に単純に数から計算しているわけではありませんね。
質量からある一定の数が出てきて、それを1モル(mol)と定義しているわけです。
なので、最初に質量12gが入っているわけです。
ですから、物質量(モル)というのは質量を表現することもできるようになります。
モル(物質量)がわかれば数だけではなくて何グラムかということもわかるようになるわけです。
質量とからめたものが物質量です。
だから物質量は粒子の数を表したものですが、
その前には質量も入っているということを知っておきましょう。
以上が物質量で、モルというものの定義の仕方です。















