前回解説した分子結晶の特徴の記事を読んでない方は
先にこちらを読んでいただきたいのですが、、、
⇒分子結晶の特徴をわかりやすく解説
上記記事の中でも、二酸化炭素(ドライアイス)のあたりを読んでみて
変に思いませんでしたか?
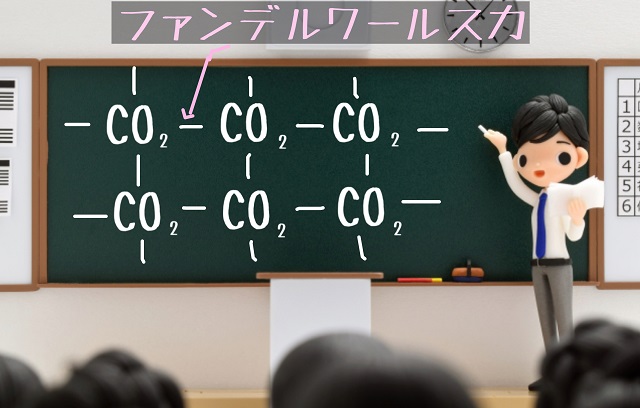
上記記事でいいたかったのは
「もう、共有結合をし終わっているからくっつく理由はない」
そういうのはファンデルワールス力でくっつくから
昇華性があるということです。

では、「水も同じじゃないの?」って感じませんか?
水だって共有結合しています。
⇒共有結合とは?簡単に例を挙げながら解説します
⇒共有結合結晶とは?わかりやすく解説
水と水が並んだら二酸化炭素と同じように昇華してしまうのではないの?って疑問です。
昇華というのは簡単にいうと氷が水にならずに、いきなり水蒸気になることです。
なので、氷から水蒸気ということで、水の状態がないのではないか?という疑問になります。

でも、水を想像したら、普通、液体の水を想像しますよね。
このことから水は例外なんだとわかります。
いったい何が例外なのか?というのが
今回のテーマになる水素結合になります。
今回の記事では水素結合とは何か?解説していきます。
水素結合とは?
水素結合を理解するために極性(きょくせい)という用語を
理解していきましょう。
まずこちらをご覧ください。

共有電子対が酸素(O)の方にちょっと寄ってますね。
このちょっと寄っているのが『極性(きょくせい)』というものになります。
$H_2O $全体はプラスマイナスゼロですよ。
ですが、中身で見てみると酸素(O)の方がちょっとマイナスの電気を帯びているのです。
電子はマイナスの電気ですからね。
あくまで外面はプラスマイナスゼロですが、
中身で見てみると酸素の方がちょっとマイナスになっているのです。
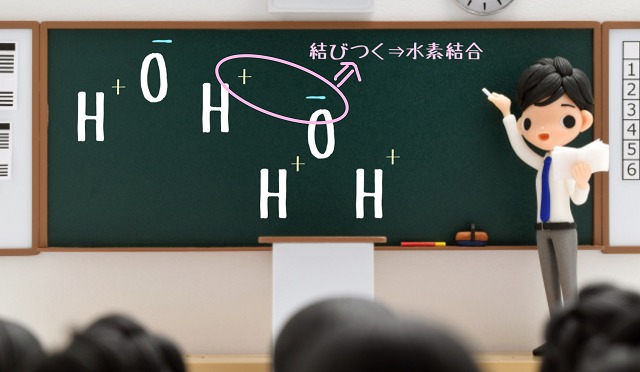
そんな感じなので、もう1つ水があったときに、
ファンデルワールス力以外にプラスとマイナスが結びつきます。
ここのことを『水素結合』といいます。
$H_2O $にはこの水素結合があるから、
ファンデルワールス力だけの$CO_2 $よりも少し結合が強いです。
水の場合、二酸化炭素よりも少し結合が強いことから、
二酸化炭素みたいに水はいきなり固体から気体になりません。
そんなことから、水素結合をしている物質の沸点や融点は他の分子と比べて高くなります。
だから昇華もしません。
これが水素結合の性質です。
また水素結合の例は、以上説明してきたように『水』が該当します。
ちなみにファンデルワールス力についてはこちらで解説しています。
⇒分子結晶の特徴をわかりやすく解説