今回の記事ではマンガン乾電池の
半反応式の意外な落とし穴についてわかりやすく解説していきます。
マンガン乾電池の半反応式
マンガン乾電池は濃淡電池なんかと比べると実用的です。
私たちが普段使っている電池ですから。
⇒濃淡電池の仕組みと反応式についてわかりやすく解説
#乾電池 #単3乾電池
製造:新日本電気(NEC)
年式:昭和52年・1977年
マンガン乾電池です。 pic.twitter.com/mmw12YQRi5— 浅野(旧機器を知るパイモン) (@old_sdtsurugaya) December 2, 2022
【豆知識】市販されている乾電池は,「赤色は容量が小さいマンガン乾電池,黒色は容量の大きいマンガン乾電池,金色はアルカリマンガン乾電池」というように,デザインの色で見分けることができるようになっている。
— ケミカズ (@chemkazu) March 14, 2023
ではマンガン乾電池って何なのでしょう?
特殊なのでしょうか?
実はボルタ電池です。
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
明治時代にボルタ電池が日本に伝わってきました。
ですが、ものすごく不便だったようです。
ボルタ電池は希硫酸を使っています。
だから落としたりしたら終了になりますから。
そこでなんとかならないかな?
と改良してできたのがマンガン乾電池です。
ところでマンガン乾電池の正極(+極)は炭素棒です。
正極が炭素棒だと聞くと「銅板じゃないの?」
って声が聞こえてきそうです。
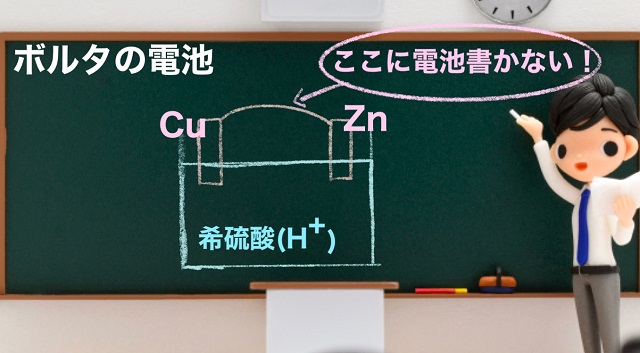
ボルタ電池は銅板でしたからね。
ボルタ電池の記事を復習していただけるとうれしいのですが、
銅板は反応していませんでしたね。
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
だから正極は電気を通せばよいので別に銅板でなくてもOKです。
そこでマンガン乾電池では炭素棒を利用することになったようです。
それから負極(マイナス極)は亜鉛板です。
ここからが本題です。
$2H^{+} $+$2e^{ー} $⇒$H_2 $
となります。
+極では水素イオンが電子をもらっているのです。
希硫酸は入っていませんから、塩化アンモニウムなどの酸性のものの影響で
水素イオンが存在しています。
酸性のものが入っていれば当然、水素イオンが出ますからね。
それから
$Zn $⇒$Zn^{2+} $+$2e^{ー} $
となります。
亜鉛が溶けていきます。
つまり
正極:$2H^{+} $+$2e^{ー} $⇒$H_2 $
負極:$Zn $⇒$Zn^{2+} $+$2e^{ー} $
となります。
これってボルタ電池の半反応式と同じですね。
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
マンガン乾電池の半反応式は基本はボルタ電池です。
そしてボルタ電池では使いにくいからいろんな工夫をしているだけです。
たとえば分極。水素ガスがたまってきたらどうしましょう?
銅板の表面に水素の泡ができ、
突然電流が流れにくくなることがあります。
これを分極といいます。
分極もボルタ電池のところで解説しています。
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
$2H^{+} $+$2e^{ー} $⇒$H_2 $
のところでどんどん$H_2 $(水素ガス)がたまっていきますね。
分極を防ぐにはどうすればよいのでしょうか?
分極を防ぐには減極剤を利用すればよいわけですね。
マンガン乾電池のマンガンは減極剤として使います。
二酸化マンガン($MnO_2 $が減極剤なのです。
つまり、水素を酸化して水にすることで分極を防ぐのです。
マンガン乾電池という名前のなので半反応式にマンガンが出てきそうですね。
ですが、マンガンは脇役です。主役じゃありません。
二酸化マンガンは減極剤として利用しているにすぎません。
ヤフー知恵袋を見ているとマンガン乾電池の半反応式にマンガンを書いている人がいました。
でもそれは間違いです。
あとは
正極:$2H^{+} $+$2e^{ー} $⇒$H_2 $
負極:$Zn $⇒$Zn^{2+} $+$2e^{ー} $
の負極の$Zn^{2+} $(亜鉛イオン)を錯イオンにして取って
逆起電力を防ぐとか、細かいところはいっぱいあります。
ただこの記事ではマンガン乾電池の半反応式の解説なので
ここまでにします。
基本はボルタ電池ということを理解しておきましょう。
以上で解説を終わります。