・分留
・蒸留
・ろ過
などがあります。
今回の記事では分留と蒸留の違いについてわかりやすく解説します。
Contents
分留と蒸留の違い
分留

たとえば、水とお酒が混ざったとしましょう。
お酒好きな人だと困りますよね。
水で混ざった薄いお酒なんて飲みたくありません。

どうにかしてお酒と水を分けて
おいしくお酒を飲みたい事でしょう。
では、水とお酒が混ざったらどうやって分けたらよいでしょう?
お酒の主成分はエタノール($C_2H_{5}OH $)で1価のアルコールです。
なので、水とお酒というより化学的には
水とエタノールを分ける方法についてってことになります。
ということで水とエタノールってどうやって分けたらよいのでしょう?
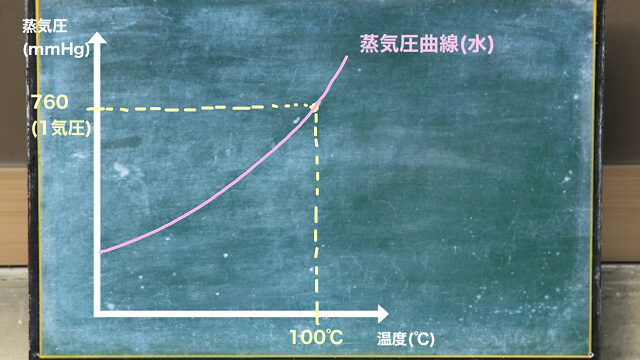
たとえば水の沸点とエタノールの沸点は違います。
・エタノールは78.37°C
・水は100°C
です。
なので、沸点の違いを利用して水とエタノールを分ければよいわけです。
ということで沸点の違いを利用するのですが、
さらにお酒(エタノール)も水も液体です。
つまり、水とエタノールという液体を沸点の違いを利用して分けます。
これを分留といいます。
液体を沸点の違いを利用して分けること
です。
蒸留
続いて食塩水を食塩と水に分けるにはどうしたらよいでしょう?
ろ過だと厳しいです。

上記画像みたいなのがろ過です。
ろ過だと食塩が水に溶けきれない固形だったらろ紙に
食塩が残るかもしれません。
でも、水に溶けきった食塩水だとろ過ではうまく分けれません。
水に溶けきった食塩水を水と食塩に分ける場合には
加熱して水を蒸発させばよいです。
海水から塩を取り出すのも加熱が有効ですね。
塩田で採った濃い海水を15分程煮詰めると、水分が飛んで白くまとまって来ます。後は自宅で1週間くらい乾燥させて出来上がり。
加熱中にピラミッド型の結晶ができる時があるそうで、面白いなぁ不思議だなぁ。 pic.twitter.com/5E2rAiSIJD— たまちゃん (@tamachibi520) August 7, 2016
こんな感じで液体の水と固体の食塩が混ざっている場合、
加熱して沸点の低い水だけを取り出す方法を蒸留といいます。
固体と液体が混ざっているときに加熱して沸点の低い液体だけを取り出す方法
です。
<2>蒸留と分留の違いまとめ
分留は液体と液体が混ざっているのを沸点の違いを利用して分ける方法です。
加熱していって沸騰する温度が低いものは先に出ていきますし
沸点が高いものは後の方で出ていきます。
蒸留は液体と固体が混ざっていて
沸点の違いを利用して分ける方法です。
では実生活で分留はどういうところで使われていると思いますか?
たとえば原油。
詳しくはこちらの記事で解説しています。
⇒原油(石油)の分留についてわかりやすく解説
今回の記事では簡単に解説しますと、
サウジアラビアやイランから原油を買ってきます。
買ってきた原油を沸点の違いによってガソリンや灯油、軽油、ジェット燃料などにわけていきす。
これが分留です。
テレビのニュースなどで原油の話が良く出てきますね。
ガソリンというのは原油から沸点の違いによって取り出されています。
そういうことを知っておくと
ニュースを見ても面白いかもしれませんね。
以上で解説を終わります。