前回までの記事でpHの計算方法や中和滴定に使用する器具の使い方について解説しました。
今回の記事では
滴定曲線の見分け方・書き方について
グラフを使ってわかりやすく解説していきます。
Contents
滴定曲線の見分け方・書き方
滴定曲線とは滴定している真っ最中のpHの変化をグラフで表した曲線のことです。
前回の記事で解説した中和滴定に使用する器具の準備が終わったら
いよいよ滴定に入ります。
そして滴定曲線を書いていくことになります。
そして滴定曲線の見分け方としては最初に解説する強酸・強塩基の組み合わせが基準になります。
強酸・強塩基の見分けがつけば、他のパターンは簡単に見分けられるようになりますよ。
ではさっそくやっていきましょう。
滴定曲線の見分け方・書き方(1)強酸・強塩基
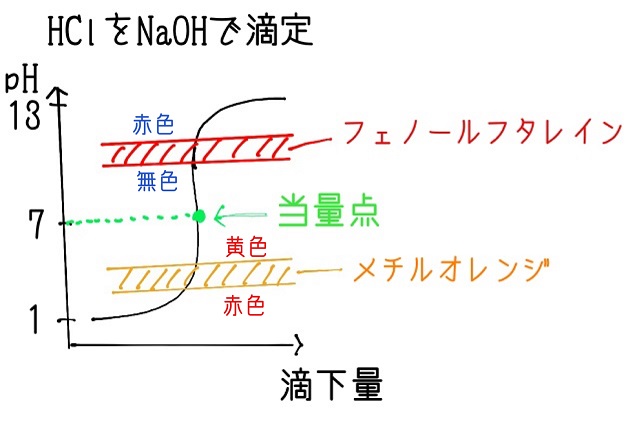
ではHClをNaOHで滴定するパターンから。
HCl(塩酸)は強酸でNaOH(水酸化ナトリウム)は強塩基です。
ではグラフを書いていきましょう。
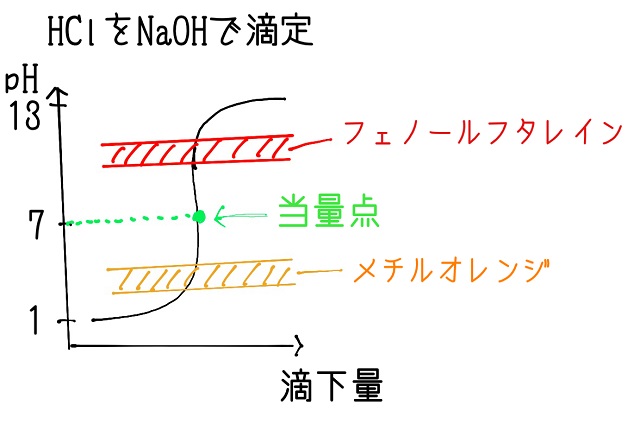
強酸と強塩基はどちらも強いので引き分けで中性になりますね。
これは以前の記事で計算方法とともに解説しています。

なのでちょうど中和するとpHは7になり上記のようなグラフになります。
今回のは強酸のHClを強塩基のNaOHで滴定したので上記グラフのようになります。
でも、強塩基のNaOHを強酸のHClで滴定したら最初にpHが13で
滴下量を増やすと酸性の方に傾いていくようなグラフになります。
ご注意ください。
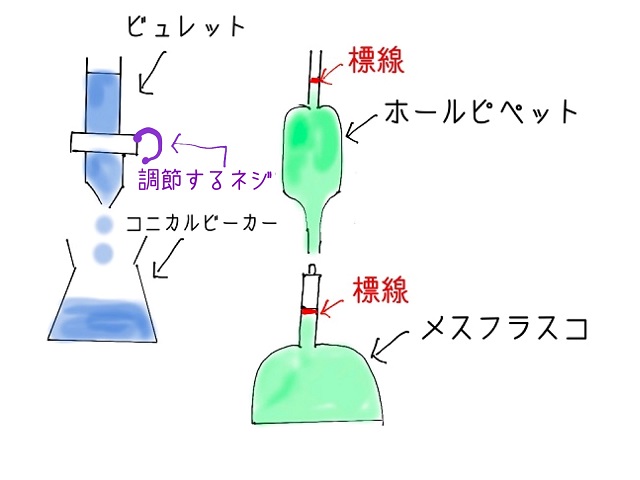
でも今回のはコニカルビーカーの方に塩酸HClがあって
ビュレットで水酸化ナトリウムNaOHを垂らしていきます。
だからはじめは酸性でだんだんアルカリになっていくようなグラフになります。
どっちにどっちを加えたか?
逆にするとグラフはひっくり返ってしまいますからね。
なので注意してください。
丸暗記はダメです。
どっちが最初にあってどっちをどっちを加えたか?
よく確認しましょう。
これだけでもあなたが悩んでいたことが解決したかもしれません。

今回は最初に塩酸でした。
そして水酸化ナトリウムNaOHを加えたから
だんだんpHが上がったというグラフです。
で、ちょうどぴったり中和するとpHが7のはず。
これを中和点とか当量点(とうりょうてん)といいます。
私が高校のときは化学の先生が『中和点』といっていました。
でも大学の化学実習のとき、教授は『当量点(とうりょうてん)』といってました。
⇒当ブログ管理人のプロフィール
なのであなたが高校生なら『中和点(ちゅうわてん)』と覚えておいた方がよいかもしれません。
でも、あなたが大学生なら『当量点』と覚えた方がよいかもしれません。
欲張りな方は両方覚えておきましょう(苦笑)。
とにかく塩酸という強酸と水酸化ナトリウムという強アルカリを混ぜたら
pHが中性の7になるでしょう。
今回のケースだとpH7が当量点(中和点)となります。
ピッタリと中和した点のこと
です。
とにかくぽたぽたと塩酸の中に水酸化ナトリウムを1滴1滴入れて
中和していくわけです。
そして最後の1滴になったとしましょう。
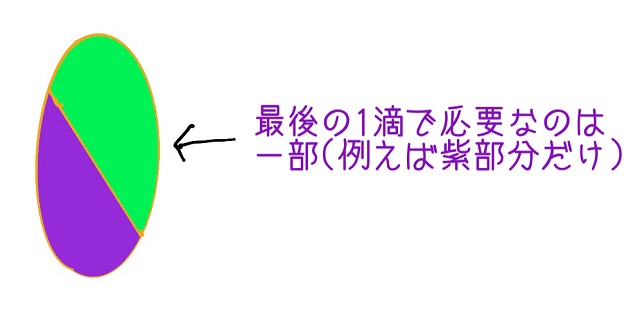
いよいよあと1滴で中和です。
ただ1滴にも体積があります。
最後の1滴で必要な量というのは丸ごとではありません。
一部でよいわけです。
最後の1滴を考えた場合、1滴にはある程度体積があります。
この1滴の一部で中和できることが一般です。
ということは中和していると余分に入ってしまうのです。
上記画像でいったら1滴でも紫部分だけ入ってくれたらよいですが、
不要な黄緑色部分まで入ったとしましょう。
黄緑色の分は本当はいらないのですが、中和滴定では
1滴ずつ入れるため仕方ありません。

で、水酸化ナトリウムは強塩基です。
弱塩基ではありません。
だから最後の1滴でバーンとpHが動いてしまうのです。
これが強酸、強塩基の特徴です。

つまり強酸、強塩基というどっちも強い時は
当量点付近におけるpHの変化が、いきなり最後の1滴で裏返るので
非常に大きいという特徴があります。
ここで指示薬の登場です。
ちょうどぴったり中和した時に溶液が「もう中和したからいらないよ」って
教えてくれませんよね。
だから指示薬を加えておくのです。
つまり、「もう中和したからいらないよ」ってことを
色の変化で示してくれるというのが指示薬です。
ちょうど中和したところを色の変化で教えてくれる物質のこと
です。
・フェノールフタレイン
・メチルオレンジ
です。
変色域はフェノールフタレイン8.3〜10.0あたりで
メチルオレンジ3.1〜4.4です。

そして変色域は位置が大事です。
色はフェノールフタレインの場合、
変色域で上の方(pHが高いほう)にいくと赤くなり、
下の方(pHが低いほう)に行くと無色になります。
変色域の中の色はだんだん変わっていくので
変色域の中の色は意味がありません。
色を見るのは変色域の外側(上下)になります。
こんな感じで変色域は位置が大事です。
フェノールフタレインの場合はアルカリ側にあるということが大事です。
pHが8.3から10.0あたりという変色域ですからね。
・変色域配置が大事(アルカリ側?酸性側?)
・色は両サイド(変色域よりpHが高い時の色は?低い時の色は?)
です。
たとえばフェノールフタレインなら
変色域はアルカリ側にあって色は変色域よりpHが高いと赤色で
低いと無色になるというのが重要です。
変色域の色は重要ではありません。
そしてもう1つ大事なのがメチルオレンジです。
メチルオレンジの変色域はpH3.1~4.4です。
色は両サイドで変色域より高いと黄色くなり
低いと赤くなります。
よろしいでしょうか?
フェノールフタレインは変色域よりpHが低いと全部無色です。
たとえばpHが3でも7でも無色です。
メチルオレンジも変色域よりもpHが高いと全部黄色です。
たとえば、pHが5でも13でも黄色です。
こんな感じで変色域と色の関係もしっかりと理解しておいてくださいね。

するとフェノールフタレインを指示薬で使ったとしましょう。
最後の1滴で無色から赤色に変化します。
今まで色が無色だったのに1滴水酸化ナトリウムを入れたら
一気に色が赤くなったということで
中和滴定をストップできるわけです。
あるいはメチルオレンジを使ったとしましょう。
メチルオレンジを使うと最初は赤いです。
でも最後の1滴で黄色くなったら滴定をストップできます。
なので強酸、強塩基の中和滴定の場合
変化が非常に大きいのでフェノールフタレイン、メチルオレンジ両方の
変色域を一気に突破する、つまりどちらを使っても色が変化します。
だから両方の指示薬を使うことができるということです。
指示薬はフェノールフタレイン、メチルオレンジ両方とも使用することができる。
ということです。
以上のことを理解しておくと
滴定曲線を見分けたり書くことができるわけです。
滴定曲線の見分け方・書き方(2)弱酸・強塩基
ここまで解説したことが分かれば
あとはここまでの内容を基準にして考えていけばOKです。
次に酢酸という弱酸と水酸化ナトリウムという強塩基のパターンを考えていきましょう。
そして酢酸を水酸化ナトリウムで滴定するパターンで考えていきますね。
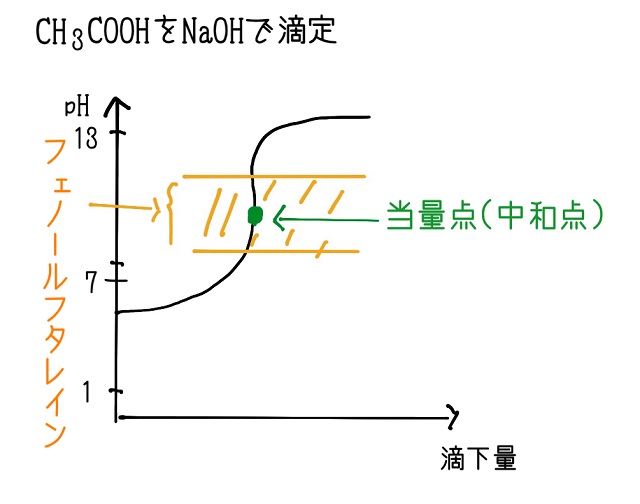
酢酸は弱酸、水酸化ナトリウムは強塩基。
中和しても強いほうに引っ張られます。
だから当量点はpH7ではありません。
これは前回の記事で解説しています。
酢酸と水酸化ナトリウムを混ぜたら酢酸ナトリウムという弱塩基性の物質ができると
前回の記事で解説しています。

なので当量点(中和点)はpH7より上にきます。
さっき強酸、強塩基という基準のグラフについて解説しましたね。
今回のは弱酸、強塩基なので塩基の方が強いのでpHが高いです。
だからグラフ自体、上に圧縮されます。

さっきのはpH1からスタートでした。

でも酢酸は弱酸なので、もっとアルカリ側からスタートするわけです。
だからさっきのグラフを上の方に圧縮したようなグラフになるわけです。
どういうことか?
メチルオレンジの変色域が意味をなさなくなります。
だってメチルオンジの変色域はpH3.1~4.4で、この位置は
今回の弱酸強塩基ではかすりもしないからです。
でもフェノールフタレインの方はちょうど当量点のところで
色が変化してくれます。
今回みたいに弱酸強塩基であっても最後の1滴で一気に動きます。
フェノールフタレインなら無色から赤色に変わります。
でもメチルオレンジは外れているから最後の1滴を使っても
色が変化しません。
つまり弱酸強塩基ではフェノールフタレインだけが
滴定に利用できるということです。
・フェノールフタレインは使えるがメチルオレンジは使えない
滴定曲線の見分け方・書き方(3)強酸・弱塩基
今度は塩酸という強酸をアンモニアという弱塩基で滴定するパターンを考えましょう。
今度は全体が酸性に寄っていきます。
できる塩化アンモニウムは弱酸性だと前回の記事で解説しています。
滴定曲線を書くと以下のようになります。
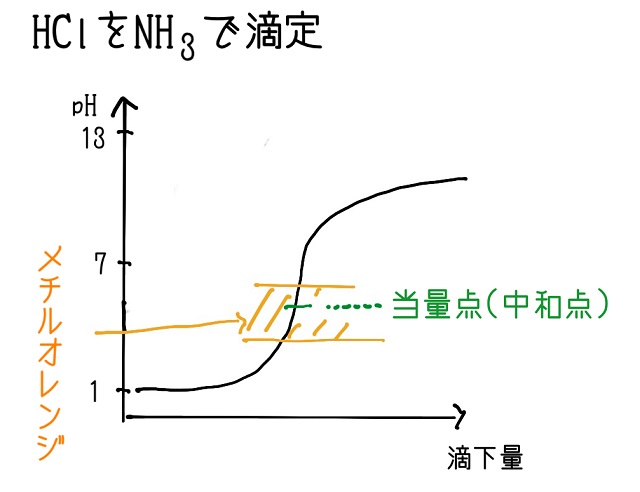
スタートはpH1に近いところからスタートしますが
当量点は7よりも下にできます。
ということはメチルオレンジは色が変わるから使えます。
でもフェノールフタレインはアルカリ側の話なので使えません。
この場合には全体に酸性の方に寄ってしまうので
メチルオレンジのみ使用できます。
メチルオレンジは使えるがフェノールフタレインは使えない
です。
滴定曲線の計算問題の解き方
濃度がわからないHCl(塩酸)10mLがあるとします。
この塩酸を滴定するのに、0.2mol/Lの水酸化ナトリウムNaOH20mL必要だった。
塩酸の濃度はいくら(mol/L)でしょう?
上記のような問題があったとしたら
あなたはどうやって塩酸の濃度を求めますか?
まずわからないものはX(エックス)(mol/L)とおきましょう。
そして塩酸の体積は10mLです。
でも、濃度の単位はmol/LとL(リットル)を使っているので
10mLを10×$10^{-3} $(L)とmL(ミリリットル)をL(リットル)に変換しておきましょう。
なので、X(mol/L)×10×$10^{-3} $(L)=10×$10^{-3} $X(mol)となりますね。
mol/LとLを掛け算したら単位における分母のLが消えるのでmolだけ残りますね。
水酸化ナトリウムの方は
10×$10^{-3} $X(mol)=0.2mol/L(水酸化ナトリウム)×20×$10^{-3} $(L)
という式が成り立ちますね。
水酸化ナトリウムの方は0.2mol/Lに対して20mLなので
0.2mol/L×20×$10^{-3} $(L)=4×$10^{-3} $(mol)となりますね。
そしてこの問題は中和滴定です。
この塩酸のmolである10×$10^{-3} $X(mol)と
水酸化ナトリウム4×$10^{-3} $(mol)が等しいわけなので
10×$10^{-3} $X(mol)=4×$10^{-3} $(mol)
となります。
今回の問題は塩酸も水酸化ナトリウムもどちらも1価なので上記式が成り立ちますね。
なので
塩酸のモル数=水酸化ナトリウムのモル数
が成り立つわけです。
もし2価の硫酸みたいなのがある場合の計算方法は
こちらの記事で解説していますので気になる方はご覧ください。
ここまでの解説が分からなかった方は
以下の記事をご覧ください。
話を元に戻します。
10×$10^{-3} $X(mol)=4×$10^{-3} $(mol)
より
X=4÷10=0.4
となりますね。
したがって塩酸の濃度は0.4mol/Lだとわかりました。
こんな感じで滴定曲線の計算問題はそんなに難しくありません。
ちゃんと指示薬は何を使ったら適切なのか?みたいな話の方が難しかったと思います。