今回は3つ目の気体法則であるアボガドロの法則について計算問題を利用しながら
わかりやすく解説していきたいと思います。
1つ目と2つ目の気体法則はこちらで解説しています。
・ボイルの法則についてわかりやすく解説
・シャルルの法則が当てはまる身近な例とは?
アボガドロの法則についてわかりやすく解説
上が母泥の法則はアボガドロ数で有名なアボガドロさんです。
アボガドロの法則とはどういうものでしょう?
圧力Pと絶対温度が一定で、気体の体積Vは物質量nに比例する
という法則のことです。
図を使ってもう少し詳しく解説しますね。
今、絶対温度がT(K)、体積がV(L)で上からPという圧力を加えた状況を考えてみましょう。
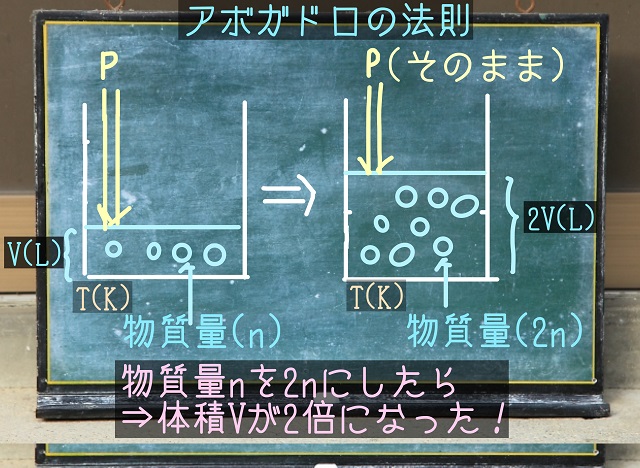
この中に入れる気体分子(上記図の左側で4つ〇がありますね)がn(mol)だったとしましょう。
中に入れる気体分子の数を2倍にしましょう(〇が8個と2倍になりました)。
上記図の右側ですが、2n(mol)になりますね。
上記図の右側は絶対温度T、圧力Pは変えてません。
でも、中に入っている気体分子が2n(mol)になったら
体積Vが2倍の2V(L)に倍増します。
これがアボガドロの法則です。
物質量n(mol)が2倍になると気体の体積も2倍になります。
同じ比率で大きくなります。
これがアボガドロの法則です。
V(体積)=定数×n(物質量)
となります。
アボガドロの法則とは体積とモル数が比例するって法則だってことですね。
アボガドロの法則についてわかっていただけましたか?
では実際に簡単な計算問題を解いてみましょう。
理解度テストみたいなものです。
アボガドロの法則が理解できたか計算問題を使って確認
$CO_2 $が1molあたり22.4Lあるとします。
今、体積Vを測定してみたところ76.16Lありました。
では現在何moLあるでしょう?
どうでしたか?
V(体積)=定数×n(物質量)
アボガドロの法則とは体積とモル数が比例するって法則のこと
でした。
なので、
体積Vが1molあたり22.4Lなのが76.16Lとなっているわけですから
現在Y(mol)の物質量があったとすると、
1mol⇒Ymol
22.4L⇒76.16L
の関係がありますね。
もし1molが2molと2倍になっているなら
22.4L×2=44.8Lなわけです。
同様に現在YmolとY倍になっているので
22.4L×Y(L)、これと76.16(L)が等しいから
22.4Y=76.16
両辺を22.4で割りましょう。
(両辺を同じ数で割っても問題ありませんね)
22.4Y÷22.4=76.16÷22.4
Y=3.4
よって3.4molとなりますね。
答えは3.4molでした。
$CO_2 $が1molあたり22.4Lあるとします。
もし0.3molだったら体積Vは何Lになりますか?
ここまでの内容が理解できたら簡単な計算問題ですね。
以下は暗記しておいた方がよいかもしれません。
もし1molが2molと2倍になったら
22.4L×2=44.8Lになります。
ここでは1molが0.3molだから
22.4L×0.3=6.72L
よって体積は6.72Lになりますね。
ここまで理解できたらとりあえずアボガドロの法則は問題ありません。
あとはあなたが受験する大学の過去問題をひたすら解いてください。
アボガドロの法則について計算問題を使って分かりやすく解説まとめ
アボガドロの法則とは体積とモル数が比例するという法則のことです。
で、1662年のボイルの法則から始まって、
アボガドロの法則は1881年です。
約150年です。
この150年の間に3つの気体法則が出てきています。
です。
この3つの気体法則を総合することで
PV=nRTという理想気体の状態方程式を導くことができます。
理想気体の状態方程式についてはこちらでも解説しています。
・理想気体と実在気体の違いと近づける方法についてわかりやすく解説
ここまで解説した3つの気体法則をしっかり理解しておきましょう。
その上で、3つの気体法則の式を組み合わせて
理想気体の状態方程式を次回の記事で導いてみたいと思います。
⇒理想気体の状態方程式をわかりやすく導出してみた!