以前の記事で共有結合結晶って何なのか?解説しました。
⇒共有結合結晶とは?わかりやすく解説
今回の記事では共有結合結晶の例をご紹介します。
共有結合結晶に該当する物質というのは
実は『ある』法則に従っています。
この法則を覚えておけば逆にいうと
芋づる式に共有結合結晶の例を逆算して導くことができるようになります。
ですのでぜひ最後までご覧いただき、
試験で共有結合結晶の例を核問題が出たら
確実に解答できるようにしていきましょう。
共有結合結晶の例と暗記のコツ
共有結合結晶というのは共有結合によってくっついている結晶のことです。
・$SiO_2 $(石英)
・Si(ケイ素)
・ダイヤモンド
・$SiC $
・黒鉛
の4つです。
なので上記5つの例を暗記した方がよいのですが、
試験は共有結合結晶の例だけが出題されるわけではありませんね。
なので、なるべき理屈抜きの暗記は避けたいところです。
そこで暗記のコツについてお伝えしたいと思います。
まず$SiO_2 $、ダイヤモンド、黒鉛はすべて炭素Cが入っています。
また、$SiO_2 $と$SiC $、Siは3つともSiが入っています。
つまり、CとSiばっかりなわけです。
「水平リーベ僕の船・・・」と周期表を思い出していくと
炭疽Cとケイ素Siは周期表で見ると縦に並んでいます。
それから横の列を見ると14族です。
つまり、暗記のコツとしては
『14族シリーズ』が共有結合結晶の構成要素なんだと理解しておくということです。
・14族シリーズ(Si,C)と覚える
です。
ちなみに$SiO_2 $(石英)、ダイヤモンド、$SiC $、Siの4つはすごく硬いですし
電気も導きにくいという特徴があります。
Si(ケイ素)はちょっと電気を導きます。
ですが、ダイヤモンドは電気を導きにくいでなく、導きません。
黒鉛は例外的です。
黒鉛は鉛筆の芯に利用されていますが、柔らかいですね。
また黒鉛は電気分解するときの炭素棒にも利用されているくらいなので電気を導くという特徴があります。
こんな感じで共有結合結晶の中で黒鉛は仲間外れ感があります。
一人ぼっちで寂しい感じがしますね。
でも一応黒鉛は炭素Cだからという理由で共有結合結晶の仲間に入れてもらっています。
同じ共有結合結晶なのにダイヤモンドと黒鉛の性質が違う理由
ではどうしてダイヤモンドは電気を導かないのに
黒鉛は電気を導くのでしょう?
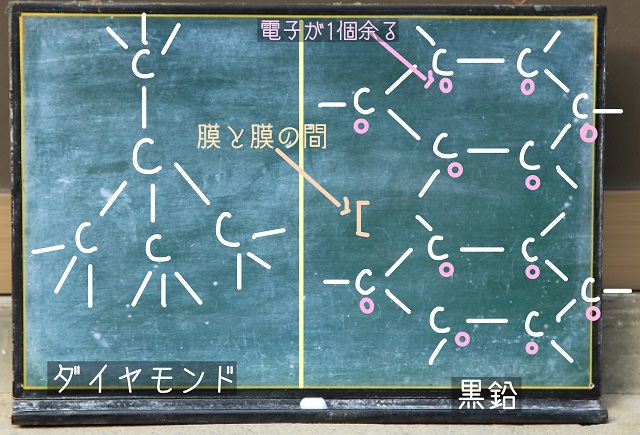
上記図をご覧ください。
左側がダイヤモンドで右側は黒鉛です。
炭素の手は4本で、ダイヤモンドは4本とも使って結合しています。
でも黒鉛は炭素の手4本のうち3本だけ使って結合しています。
ということは黒鉛の場合、手が1本余っていますね。
手が1本余っている=電子が1本余っているという意味です。
この余った電子のおかげで黒鉛の場合は電気を導くのです。
それから黒鉛の場合、層と層の間(膜と膜の間ということもある)は弱い力でくっついているので
剥がれやすいです。
だから紙の上に字を書くことができるのです。
黒鉛の場合、CとCの間は共有結合をしているので共有結合結晶です。
でも、層と層の間(膜と膜の間ということもある)は弱い力である分子間力でつながっています。
この辺が受験生、混乱するので間違えないでくださいね。
ただ図で見ると理解しやすかったと思います。
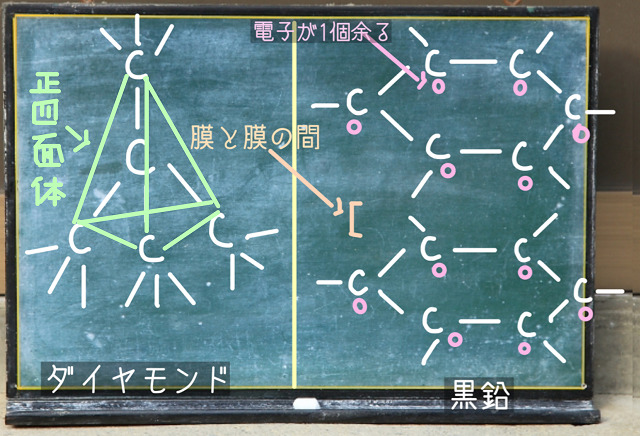
それからダイヤモンドは1個の炭素原子に4個の炭素原子が
正四面体状にくっついた共有結合をしています。
また非金属という炭素同士の結合だから共有結合になりますね。
ちなみに
非金属同士の結合を共有結合、非金属と金属の結合をイオン結合、
金属同士の結合を金属結合というのでしたね。
とはいえ、ダイヤモンドと黒鉛は結晶構造は違いますが
同じ炭素からできている同素体ということで仲間でもあります。
共有結合結晶の一例となる石英の特徴

$SiO_2 $(石英)は上記図のような構造をしていて
ダイヤモンドみたいに正四面体になっています。
ただ、上記図のようにSi1つとO4つがくっついて正四面体になってますが
さらに隣にSiがあって、同様の構造をしているのです。
こんな感じでSiとSiの間にOがあるので
$SiO_2 $でなく$SiO_4 $みたいに見えてしまいますね。
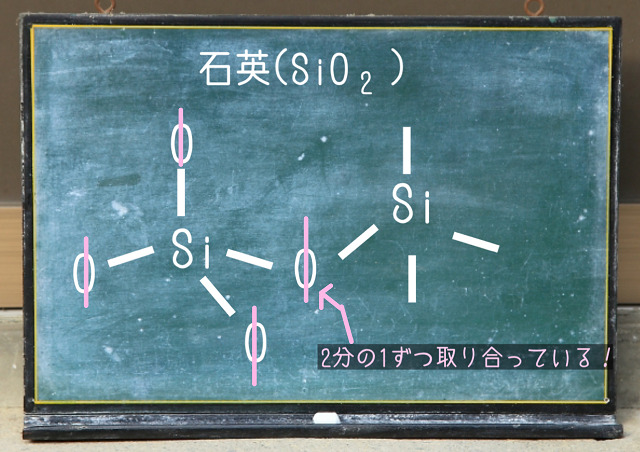
でも、両者のSiがOを半分ずつ取り合っているのです。
なので、Si1個にO半分(2分の1個)が4つくっついているということになります。
2分の1が4個あるということは2個ということですね。
2分の1×4=2ですからね。
なので$SiO_4 $でなく$SiO_2 $となるのです。
化学式になると$SiO_2 $となるのですが、
石英の結晶としてはSiが4つの酸素と非金属同士共有結合しているという表現で
試験問題で出題されることもあり、それは間違ってないのでご注意ください。

1つのSiにOが4つくっついているのは間違ってないですよね。

ちなみにケイ素の結晶はダイヤモンドのCにの部分がSiになっているだけで
ダイヤモンドと同じ正四面体構造をしていて半導体に利用されています。
あと試験には出ないかもしれませんが
共有結合の例として他にもGeやαースズ(α-錫)もあります。
・真性半導体
→四価原子のシリコン(Si)またはゲルマニウム(Ge)のみが共有結合によって結晶化純粋な半導体のこと— ちゃぴを (@chapio_mgrrk7) March 2, 2017
以上で解説を終わります。